易压印丝素蛋白水凝胶微粒作为可注射的长效填充剂
来源:医用蚕丝科技 | 作者:丝素研究院 | 发布日期: 2024-09-02 | 阅读次数:912次
摘要

老年人对具有良好生物相容性和持久性的面部填充剂有很高的需求,以克服面部凹陷。采用甲基丙烯酸缩水甘油酯修饰的丝素水凝胶打印新型可注射再生丝素(RSF)微粒来解决这个问题。RSF水凝胶的β-片含量和力学性能可以通过冻融循环次数进行调节,RSF水凝胶在盐水中的溶胀率可以忽略不计。打印的RSF微粒均匀,直径约为300-500 μm,可以通过打印屏幕的孔径进行调节。用26号针注射后,RSF微粒的尺寸分布没有明显变化,说明微颗粒在注射过程中能够承受剪切应变而不破裂。体外实验表明,RSF不仅具有良好的生物相容性,而且有利于成纤维细胞的迁移。皮下注射实验表明,RSF微粒在注射部位形成持久的隆起。组织切片显示,第8周RSF微粒仍然明显,微粒周围形成血管。这些数据表明,打印的RSF微粒在面部年轻化方面具有巨大的潜力。
研究内容
蚕茧在脱胶后溶解于溴化锂溶液中1 h。将GMA倒入溶液中,在60℃下搅拌6 h。反应结束后,透析并冷冻干燥。冷冻干燥的GMA-SF在室温下溶解得到浓度为30%的溶液,加入光引发剂,然后将混合物转移到模具中,用波长为365 nm的紫外光照射光固化,制备RSF水凝胶。对水凝胶进行不同的冻融循环处理,以调节β-片的含量。使用不锈钢筛网对其进行过筛。
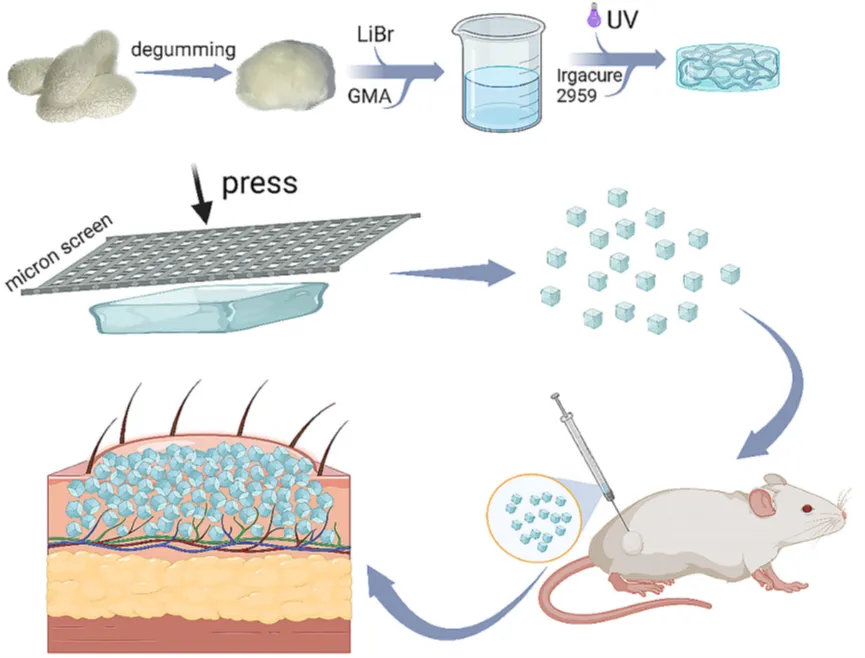
图1 RSF水凝胶微粒的制备及其作为注射填料的应用示意图。
图2A-D所示,制备的4种不同冻融周期的RSF水凝胶的透明度与循环次数成反比。SEM图像(图2E-H)显示,所有水凝胶都具有均匀且相互连接的多孔结构。采用压汞法定量测定了RSF水凝胶的孔隙度和孔径分布。从图2I可以看出,经过冻融处理的RSF水凝胶的平均孔径大于FT-0水凝胶的平均孔径,与SEM结果一致。4种不同冻融孔隙率差异不大,说明冻融对RSF水凝胶孔隙率无明显影响。通过XRD分析对RSF水凝胶的晶体结构进行评价(图2J)。FT-0在20°左右出现一个加宽的峰,表明β-片的含量较低。相比之下,经过冻融处理的RSF水凝胶的XRD有很大不同。这些水凝胶分别在16.7°和22.8°处有2个衍射峰。图2K采用拉曼光谱对样品进行表征,结果显示,FT-1、FT-2和FT-3的β-折叠对应的峰位于1663 cm-1和1236 cm-1。如图2M-P所示,当冻融循环次数从0次增加到3次时,水凝胶中β-折叠结构的含量从15.6%增加到32.9%,这证实了RSF水凝胶中β-折叠的含量可以通过冻融方法进行调节。图2Q和图R所示,所有RSF水凝胶均呈现稳定的水凝胶状态,且在测试范围内,存储模量(G′)始终大于损耗模量(G″)。

图2 GMA-SF水凝胶的物理化学表征。
溶胀会影响RSF水凝胶的力学性能和可注射性,图3B所示,溶胀5h后,FT-0的溶胀率分别为81.4%(水中)、18.7% (PBS中)和20.1%(生理盐水中)。当延长至14 d时,水凝胶的溶胀达到平衡。RSF水凝胶在去离子水中的溶胀率明显高于在PBS和生理盐水中的溶胀率。图3D可知,FT-0、FT-1和FT-2在生理盐水中5 h后的溶胀率分别约为20.1%、8.5%和6.8%,当时间延长至14 d时(图3E),FT-0、FT-1和FT-2在生理盐水中的溶胀率分别约为46.1%、1.6%和2.2%。图3L评估了RSF水凝胶在盐水中水化后的压缩应变-应力曲线,溶胀后RSF水凝胶的可压缩性略有下降,但仍能承受60%的压应变而不断裂,说明溶胀后的RSF水凝胶仍可用于注射。

图3 (A)水凝胶的溶胀示意图。(B-C) FT-0在不同溶液中0-5 h和1-14天的溶胀率。(D、E) FT-0、FT-1、FT-2在生理盐水中0 ~ 5 h、1 ~ 14 D溶胀率。(F-H) FT-0、FT-1和FT-2在生理盐水中1个月后的FTIR光谱。(I-K) FT-0、FT-1和FT-2在生理盐水中2个月后的FTIR光谱。(L)溶胀FT-0、FT-1和FT-2的压缩应变-应力曲线。
RSF水凝胶应切割成微粒,以适合26号针头(内径= 260 μm)推注,如图4A所示。图4B的显微镜图像显示,过筛后的颗粒直径相似。微颗粒在注射过程中是否破裂是真皮填充剂的一个重要指标,因为这些碎片很容易被流动的体液带走或被免疫细胞吞噬,对填充剂有害。因此,通过显微镜和DLS来评估注射微粒的大小。图4D显示,所有注入的颗粒的直径都在几百微米左右,没有观察到明显的断裂。图4E显示,注入颗粒仍具有均匀的尺寸分布。

图4 (A)制备打印RSF水凝胶微粒示意图。(B)孔径为150 µm的筛网打印的FT-0、FT-1和FT-2微粒的显微镜图像。比例尺= 200 μm。(C)孔径为150 µm的筛网打印的FT-0、FT-1和FT-2微粒的粒径分布曲线。(D) 26号针注射后FT-0、FT-1和FT-2微粒的显微镜图像。比例尺= 200 μm。(E) 26号针注射后FT-0、FT-1和FT-2微粒的粒径分布曲线。
采用活/死染色和MTT法检测RSF水凝胶微粒的细胞毒性。如图5A所示,L929细胞以绿色荧光(活细胞)为主,几乎没有观察到代表死细胞的红色荧光,说明共孵育不会导致L929细胞死亡。图5B为孵育24 h后的细胞活力。当RSF水凝胶微粒浓度低于9 mg/mL时,细胞活力大于80%。活/死染色数据和MTT试验确定所有RSF水凝胶微颗粒具有理想的生物相容性。抓痕实验来验证RSF水凝胶微粒促进L929的迁移。图5C显示,FT-0、FT-1和FT-2在24 h和48 h都显著地刺激了L929向划痕区域的迁移。这些数据表明,RSF水凝胶微粒可能促进成纤维细胞向注射部位迁移,从而有利于胶原纤维的沉积。

图5 体外定量和定性粘附试验。
将RSF水凝胶微粒(300 mg)分散于0.3%透明质酸溶液(1 mL)中,皮下注射大鼠背部。0.3%玻尿酸的大鼠设为对照组。用数码相机记录注射部位,并在预定时间点(2、4、6、8周)获得大鼠体重。如图6B所示,各组大鼠在注射后立即形成直径为20 mm的隆起。值得注意的是,对照组的隆起在2周后完全消失。而FT-0、FT-1和FT-2组的隆起仍然明显,大小减小到10 mm左右。当时间延长到4、6和8周时,FT-0、FT-1和FT-2组的斑点仅略有缩小。图6C中相应的隆起体积半量化也表现出类似的趋势。

图6 (A)皮下注射实验示意图。(B)大鼠皮下注射0、2、4、6、8周后的照片。(C) 0-8周注射部位的剩余隆起体积(n = 3)。(D)注射实验期间大鼠体重变化(n =3)。
如图7A所示,在对照组的组织切片中未观察到任何注射剂,这与图6B中消失的隆起相吻合。相比之下,在其他组中可以看到微颗粒。此外,RSF水凝胶微粒的大小随着时间的延长没有明显的变化,微颗粒没有破裂,表明其体内降解率相对较低。通过CD31荧光染色检测斑点组织中新形成的血管。如图7B所示,大量细胞(蓝色为DAPI)聚集,FT-0、FT-1和FT-2组细胞中出现了明显的空洞,说明微粒被细胞包裹。CD31的红色荧光也很显著,证实了新形成的血管的存在。相应的CD31定量(图7C)显示,注射2周后,CD31的相对荧光强度分别为5.8、29.8、43.8和47.1,在第8周增加到9.3、53.1、58.4和68.7,证实FT-0血密度,FT-1和FT-2显著高于对照组。

图7 (A)皮下注射2、4、6和8周后隆起内的H&E染色组织。比例尺= 500 μm。(B)皮下注射2、4、6、8周后隆起内荧光染色(CD31)组织。比例尺= 200 μm。(C)血管密度定量(n = 3)。
结论
大块的RSF水凝胶可以很容易地打成微粒,以制备具有持久影响和普遍成本的生物相容性面部填充物。所得RSF水凝胶微粒具有均匀的粒径分布和良好的力学性能,可确保微粒顺利通过26号针而不断裂。皮下注射实验表明,RSF微粒在随后的2个月内在该部位形成持久的隆起。组织切片证实,这些微颗粒没有明显降解,并且在微颗粒周围形成血管。这些数据表明,这是一种简便的方法,以获得有前途的基于RSF的注射填充物。
原文链接:
https://doi. 10.1039/d3bm01488f
(esilk.net声明:本网登载此文旨在传递更多行业资讯,文章内容仅供参考。)
